Densidade dos Gases Tóxicos
Os trabalhos realizados em espaço confinado apresentam algumas nuances interessantes quando tomados ao pé da letra em determinadas situações. Quando, por exemplo, se diz que é preciso realizar uma medição quantitativa das concentrações de gases presentes em determinadas atmosferas confinadas antes da realização de uma atividade com ocupação humana, não é dito a que profundidade é necessário que essa medição seja feita. Outro exemplo é quando da necessidade de instalação de pontos fixos de monitoramento de gases em plantas industriais. Várias vezes encontrei detectores de gás instalados em locais pouco estratégicos ou sem nenhuma funcionalidade. Com um pouco de conhecimento é possível diminuir significativamente essa lacuna e aproveitar melhor os monitores portáteis de gases e realizar a instalação de detectores fixos de maneira mais proveitosa.
Os dois exemplos, citados acima, têm em comum uma característica física de todo gás, a densidade (d). A densidade pode ser expressa como:
d = m/V
Onde:
m – Massa
v – volume
Através da Equação de Clapeyron
P · V = n ·R · T
Onde,
P – Pressão
V – Volume
n – quantidade de mols do gás
R – Constante de proporcionalidade (constante universal dos Gases)
T – Temperatura (em Kelvin)
Como n = m/M
Substituindo na fórmula de Clapeyron
P.V = m/M x R.T
P.M = m/V x R x T
Portanto:
d = (P x M) / (R x T)
Assim,
d1 / d2 = M1/M2
Ou
d1,2 = M1/M2
Como o ar atmosférico é uma mistura de diversos gases, sendo que a parte mais significativa é composta por 78% de nitrogênio (N2), e 21% de oxigênio(O2). Desconsiderando o 1% restante, composto por diversos outros gases, e sendo a massa atômica do nitrogênio igual a 14g e a massa atômica do oxigênio igual a 16g, a massa molar de N2 28g e do O2 igual a 32g e considerando as proporções dos gases no ar chegamos a algo por volta de 28,56 g. Como ainda existe o 1% descartado dos cálculos procura-se arredondar a massa molar do ar atmosférico para 29 g, ou seja, a massa molar do ar atmosférico é aproximadamente 29 gramas.
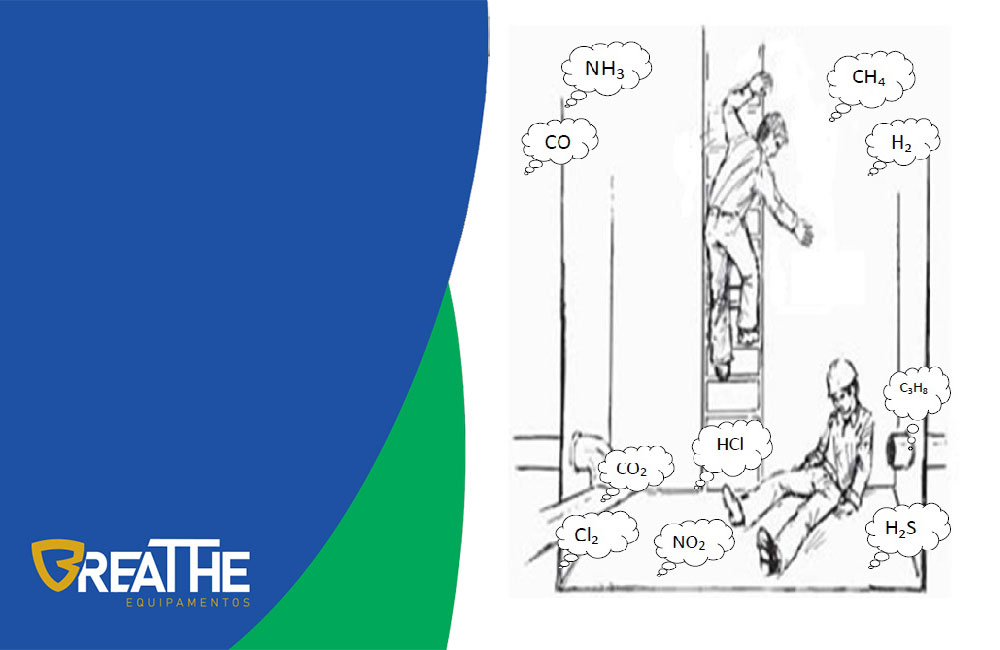
Gases tóxicos mais pesados que o ar atmosférico
Portanto, quando o resultado da massa molar de um gás for maior que 29 g consideramos esse gás mais pesado que o ar atmosférico e, portanto, encontrado mais próximo ao solo.
Gases tóxicos mais leves que o ar atmosférico
Quando por outro lado a massa molar resultar em algo menor ou igual a 29 g é dito que esse gás é mais leve que o ar atmosférico e que, portanto, tende a subir.
A lista dos 20 gases mais tóxicos do mundo e suas respectivas densidades
Aqui estão as densidades dos 20 gases mais comuns e mais tóxicos do mundo (em condições padrão de temperatura e pressão (CNTP):
Para efeito comparativo considere a densidade do ar atmosférico como 1,225 gramas por litro (g/L) (a 0°C e 1 atm).
- Cloreto de hidrogênio (HCl): 1,639 g/L
- Cloro (Cl2): 3,214 g/L
- Fluoreto de hidrogênio (HF): 0,987 g/L
- Gás mostarda (C4H8Cl2S): 1,63 g/L
- Arsina (AsH3): 2,86 g/L
- Dióxido de enxofre (SO2): 2,927 g/L
- Acetileno (C2H2): 1,092 g/L
- Ácido cianídrico (HCN): 0,687 g/L
- Anidrido sulfuroso (SO3): 1,92 g/L
- Amônia (NH3): 0,771 g/L
- Fosfina (PH3): 1,413 g/L
- Bromo (Br2): 7,59 g/L
- Cloropicrina (C5H5ClN2O): 2,28 g/L
- Monóxido de carbono (CO): 1,25 g/L
- Tetracloreto de carbono (CCl4): 1,594 g/L
- Óxido de nitrogênio (NO2): 1,8 g/L
- Dióxido de cloro (ClO2): 2,9 g/L
- Cianogênio (C2N2): 2,162 g/L
- Hidrazina (N2H4): 1,003 g/L
- Sulfeto de hidrogênio (H2S): 1,363 g/L